pharma.regulations
Mit Sicherheit alle
Anforderungen erfüllen

Die Qualitätsanforderungen und -Kontrollen sind bei medizintechnischen und pharmazeutischen Produkten und deren Fertigungsprozessen strenger als in jedem anderen Industriebereich. Die Hersteller haben die Pflicht, sowohl die Produktqualität als auch die Integrität der Prüfdaten einer automatisierten Inspektion sicherzustellen.
Hierzu müssen viele komplexe Anforderungen aus nationalen oder internationalen Normen, Gesetzen und Richtlinien eingehalten werden. Bildverarbeitende Inspektionssysteme zur Qualitätssicherung fallen unter die Kategorie „computergestützte Systeme“ und unterliegen somit besonders hohen Anforderungen.
In der pharmazeutischen Industrie sind in diesem Zusammenhang Begriffe wie cGMP, GAMP, Audit-Trails und CFR-Konformität allgemein bekannt. Welche Regularien für die automatisierte Qualitätssicherung gelten, erklären wir Ihnen mit den nachfolgenden Informationen. Als zertifizierter Experte für Inspektionssysteme für die Pharma- und Gesundheitsindustrie verfügt OCTUM über das entsprechende Know-how und die Erfahrung, um Sie bei der Gestaltung Ihrer Inspektionssysteme zur Qualitätssicherung kompetent zu unterstützen. Kontaktieren Sie uns noch heute.

Sie haben Fragen?
Sprechen Sie direkt mit einem unserer
Experten unter +49 7062 91494-0
oder schreiben Sie uns über unser Kontaktformular
Übersicht
Regularien für die automatisierte Qualitätssicherung von Pharmaprodukten
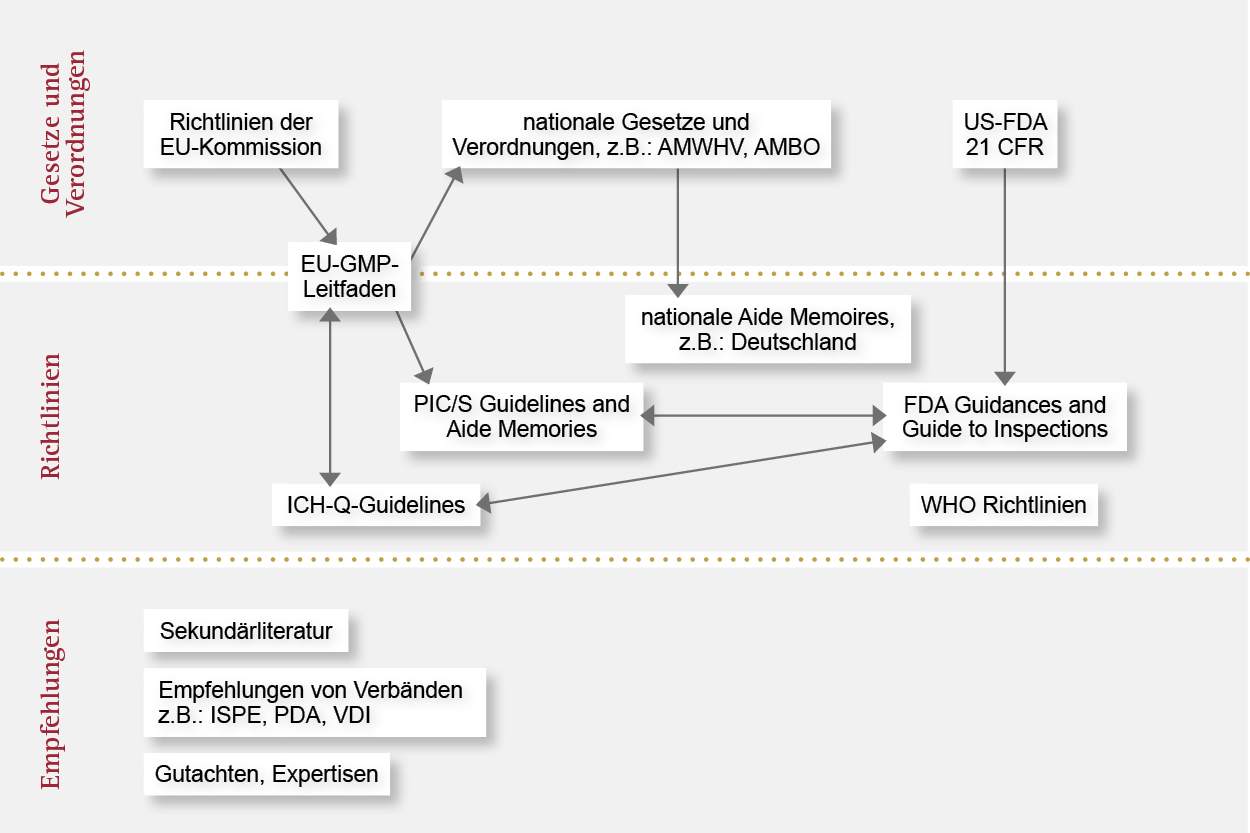
Für eine automatisierte Qualitätssicherung im Prozess gelten Richtlinien auf drei Ebenen. Wir kennen uns mit den Anforderungen aus und geben Ihnen die Sicherheit, Qualität auf höchstem Niveau zu erhalten.
Hie geben wir Ihnen einen Überblick über das Zusammenspiel der einzelnen geltenden Regularien: von den Gesetzen und Verordnungen einzelner Länder über Richtlinien bis zu Empfehlungen. Mit OCTUM setzen Sie auf einen zuverlässigen und erfahrenen Partner für Inline-Qualitätssicherung mit bildverarbeitungsbasierten Inspektionssystemen.
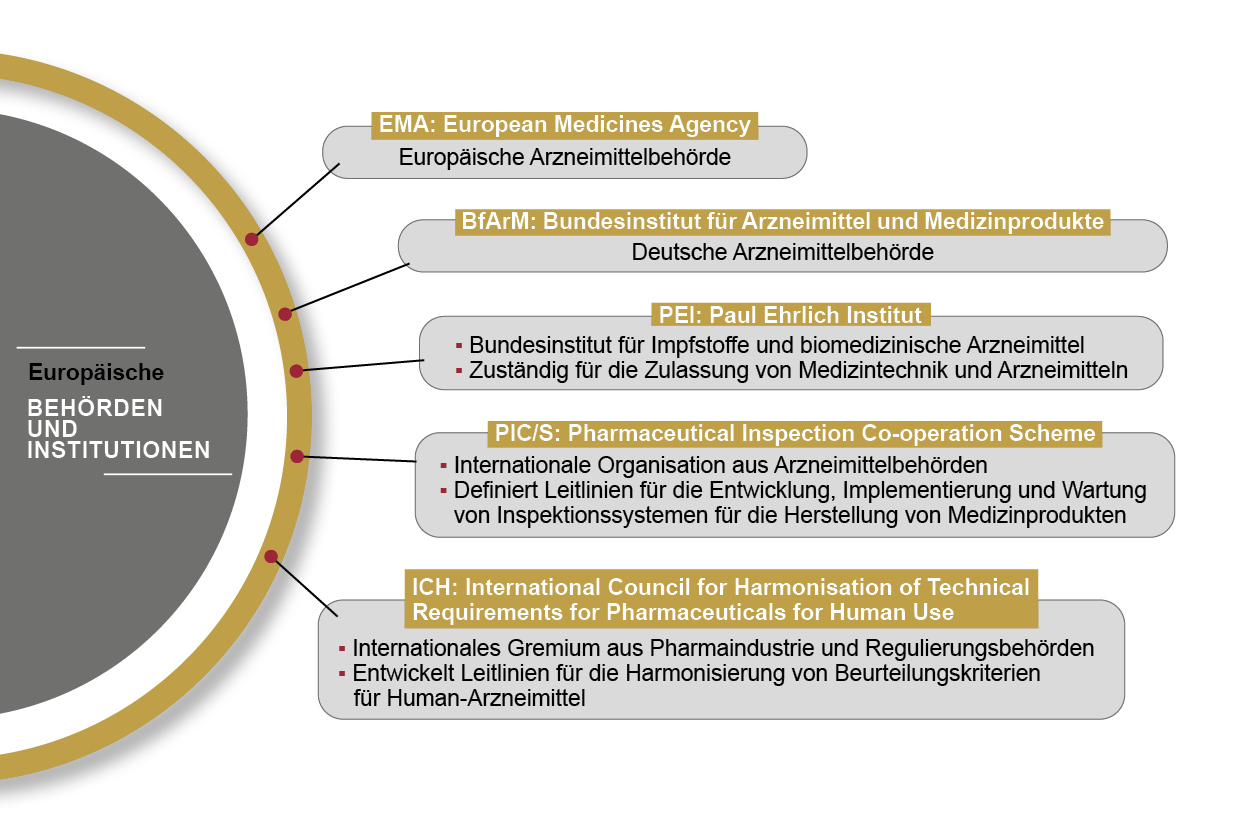
Der Umgang mit medizintechnischen und pharmazeutischen Produkten wird in der europäischen Union einheitlich von der European Medicines Agency (EMA) reguliert. Auf Basis der Richtlinien der EU-Kommission gibt die EMA Leitfäden heraus, deren Umsetzung in nationales Recht durch die Arzneimittelbehörden der einzelnen Mitgliedsstaaten erfolgt.
Bei der Auslegung und Fertigung von automatisierten Inspektionssystemen muss eine Vielzahl von Regularien und Empfehlungen beachtet werden. Beispielsweise beschreibt der Leitfaden EU-GMP Annex 11 ähnlich wie CFR 21 Part 11 die Anforderungen an computergestützte Systeme, geht aber darüber hinaus u.a. auch auf die Themen Qualifizierung und Validierung ein. Letzteres wird im zugehörigen Leitfaden Annex 15 im Detail definiert.
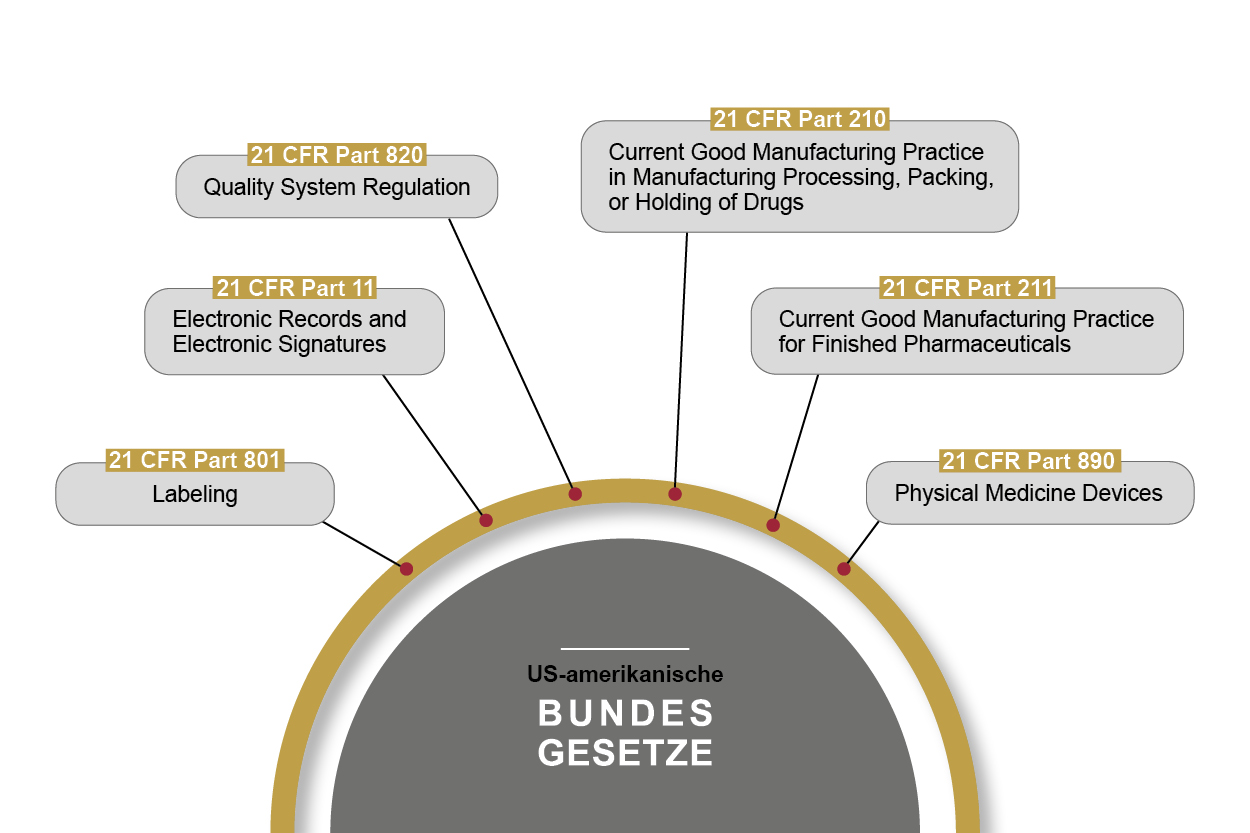
Die Food and Drug Administration – FDA – ist als US-amerikanische Behörde verantwortlich für die zentrale Zulassung und Marktüberwachung von pharmazeutischen und medizintechnischen Produkten. Die FDA überwacht den Markt aktiver als europäische Behörden, u. a. mit Vor-Ort-Inspektionen. OCTUM-Lösungen orientieren sich daher stets an den strengsten Regularien und Vorgaben.
21 CFR Part 11 ist in diesem Zusammenhang das wohl bekannteste US-amerikanische Bundesgesetz der FDA. Es definiert die Anforderungen an computergestützte Systeme beim Umgang u. a. mit pharmazeutischen Produkten. Dies umfasst die Voraussetzungen für die Verlässlichkeit und Vertrauenswürdigkeit digitaler Dokumente analog zu traditionellen Aufzeichnungen. Part 11 definiert, unter welchen Bedingungen elektronische Aufzeichnungen und Unterschriften bei computergestützten Systemen als vertrauenswürdig und verlässlich gelten. Darüber hinaus sind einige weitere Teile von 21 CFR zu beachten.
Der Leitfaden “Good Automated Manufacturing Practice 5” gilt als Standardregelwerk für die Validierung computergestützter Systeme in den Bereichen Pharma- und Medizintechnik. Er definiert Anforderungen an Planung, Inbetriebnahme, Validierung und Qualifizierung – u. a. von Produktionsanlagen. Herausgegeben wird der Leitfaden von der International Society of Pharmaceutical Engineers (ISPE), in deren Gremien u. a. Arzneimittelbehörden und Experten aus der Pharmaindustrie vertreten sind.
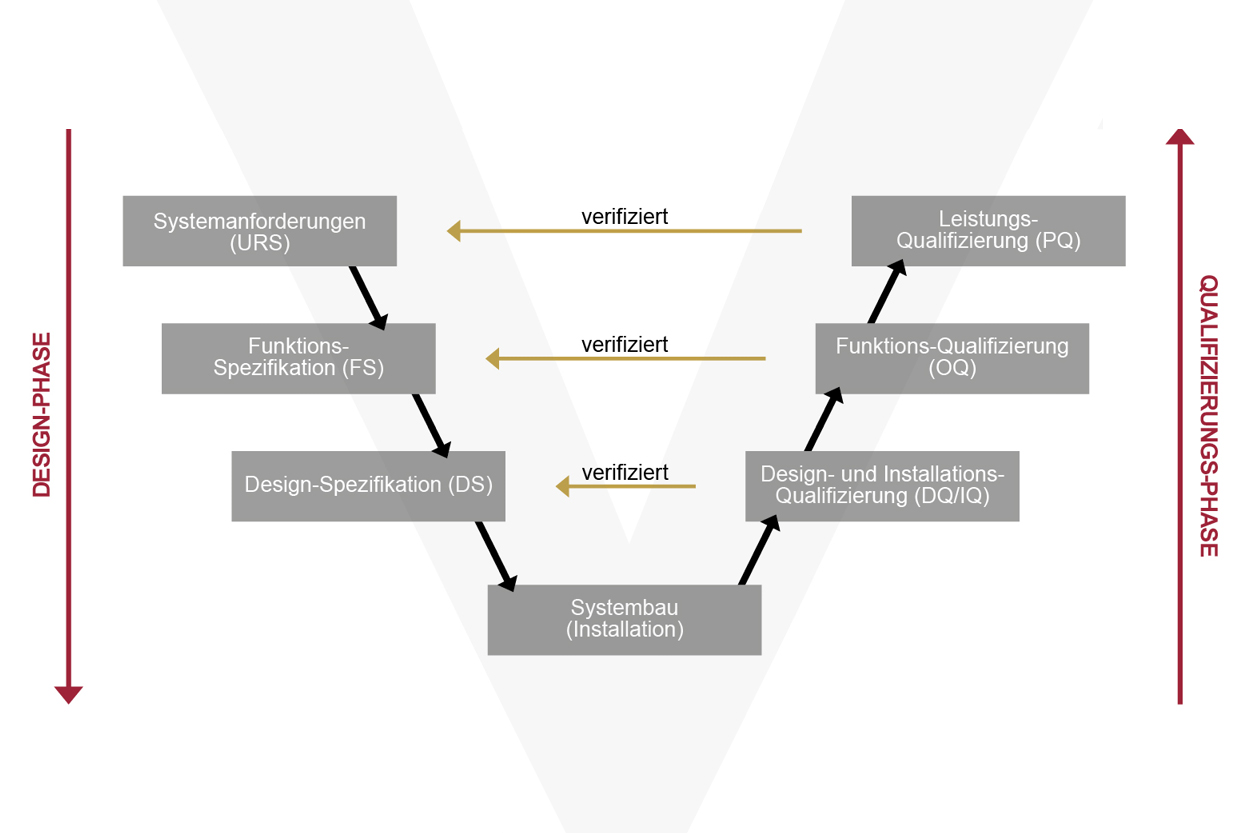
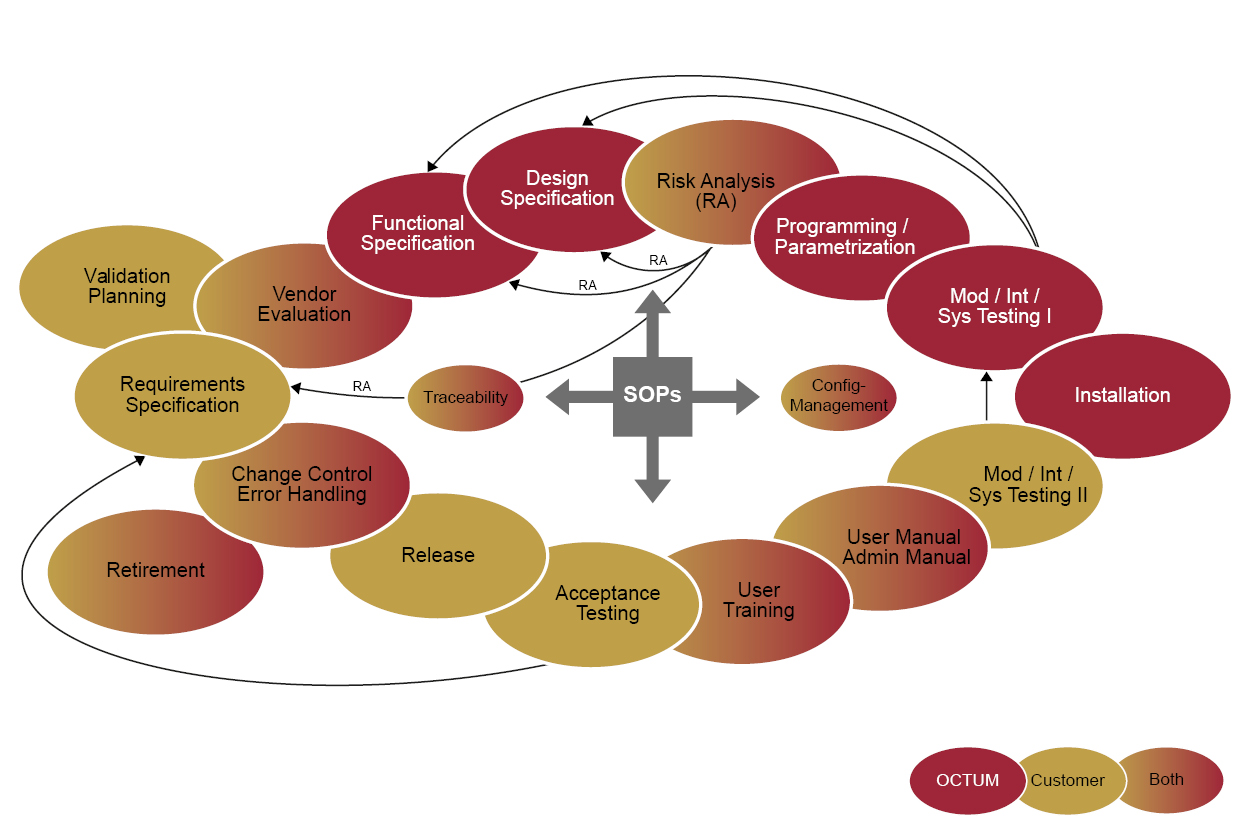
Bei GAMP5 handelt es sich nicht um ein Gesetz, sondern um eine empfohlene Methodik zur Entwicklung eines konformen computergestützten Systems. Der GAMP5 Software Lifecycle beschreibt die Anforderungen von der Planung bis zum Produktionsbetrieb automatisierter Systeme unter Berücksichtigung aller zu erwartenden Risiken.
In der Praxis werden Funktion (FS) und Design (DS) des Systems mit direktem Bezug auf die URS (User Requirement Specification) ausgelegt. Das System wird nach einer spezifischen Risikoanalyse realisiert und in der Maschine in Betrieb genommen. In der anschließenden Qualifizierungsphase wird im Rahmen von Installation, Operational und Performance Qualification (IQ/OQ/PQ) verifiziert und protokolliert, ob das Gesamtsystem den Spezifikationen entspricht.
Inspektionssysteme von OCTUM wurden speziell für die Pharmaindustrie entwickelt und sind seit 1996 in der Produktion etabliert. Durch unsere langjährige Erfahrung u. a. in den Bereichen Vials, Spritzen, Pipetten und Pflaster sind unsere Lösungen auf die hohen Anforderungen der Industrie zugeschnitten und entsprechen allen erforderlichen Regularien. Unser Leistungsumfang erstreckt sich von der Beratung und Planung bis zur konformen Realisierung und Qualifizierung des Gesamtsystems – inklusive aller regulatorisch notwendigen Dokumente.